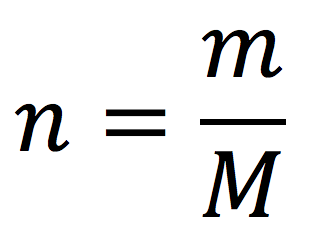Masas moleculares
Calcula las masas moleculares de las siguientes sales, que se utilizan como fertilizantes, para devolver los nutrientes al suelo:
- (NH4)2SO4
- Ca3(PO4)2

Fotografía 1.1.I. Añadiendo fertilizantes. Obtenida de flickr.com (CC BY 2.0)
Instrucciones: ejecuta el título de las diferentes pestañas a continuación, para observar la resolución del problema. Lee atentamente la información de forma que te sea comprensible el procedimiento realizado. Se te recomienda hacer el procedimiento al mismo tiempo en tu cuaderno para mejorar el aprendizaje.
1. (NH4)2SO4
1. Lo primero es identificar qué elementos están presentes en la fórmula y obtener su masa atómica de la tabla periódica de los elementos:
- Nitrógeno (N): 14 uma.
- Hidrógeno (H): 1 uma.
- Azufre (S): 32 uma.
- Oxígeno (O): 16 uma.
2. Después, se cuenta el número de átomos que hay de cada uno de los elementos en la fórmula. Si hay un subíndice fuera de un paréntesis, hay que multiplicar el número de átomos de los elementos que están dentro de este.
- N: 2 átomos (se multiplicó por el subíndice fuera del paréntesis).
- H: 8 átomos (por la misma razón anterior).
- S: 1 átomo.
- O: 4 átomos.
3. Se multiplica la masa atómica de cada elemento por el número de átomos que hay de ese mismo elemento.
- N: (14 uma)(2) = 28 uma
- H: (1 uma)(8) = 8 uma
- S: (32 uma)(1) = 32 uma
- O: (16 uma)(4) = 64 uma
Finalmente, al hacer la suma, se obtiene la masa molecular del (NH4)2SO4 = 132 uma.
2. Ca3(PO4)2
Este procedimiento se hará más directo y conciso, ya que en un solo paso se identificará el número de átomos de los elementos y se multiplica por la masa atómica.
1. Identificamos los elementos y buscamos su masa atómica:
- Calcio (Ca) = 40 uma
- Fósforo (P) = 31 uma
- Oxígeno (O) = 16 uma
2. Obtenemos la masa molecular, de la siguiente forma:
- Ca: (40 uma)(3) = 120 uma
- P: (31 uma)(2) = 62 uma
- O: (16 uma)(8) = 128 uma
La suma de lo anterior resulta en la masa molecular del Ca3(PO4)2 = 310 uma.