Conocimiento previo
Este es un tema del programa de Química II. La estequiometría es la parte de la química que se dedica a los aspectos cuantitativos (aquello que se contabiliza) de las sustancias y sus cambios (reacciones químicas).
En la química, es muy importante conocer cuánto hay que agregar de cada sustancia (reactivos) o cuánto producto se va a obtener de una reacción química.
Así como en una receta de cocina, es fundamental conocer la cantidad de cada ingrediente, para que el platillo que se vaya a preparar quede como se desea o en la cantidad que se necesite.
Antes de realizar cálculos en química, es necesario que repases conceptos tales como: masa atómica, masa molecular, mol y masa molar; así como saber convertir entre mol y gramos.
Instrucciones: ejecuta en cada una de las pestañas el concepto a revisar y lee con atención la información presentada.
Masa atómica
Expresa la masa de un átomo en unidades de masa atómica (uma). Está relacionada con el número de masa (A), que es el número de partículas en el núcleo de un átomo, es decir, a la suma de protones (p+, cargados positivamente) y neutrones (n±, sin carga neta). Si el número atómico (Z) significa el número de protones, entonces: A = p+ + n± = Z + n±.
Ejemplo: un átomo de sodio, con un número atómico Z = 11 y un número de masa A = 23. Esto quiere decir que tiene 11 protones en su núcleo y para alcanzar el valor de A, deberá tener 12 neutrones también.
La masa atómica que está reportada en la tabla periódica para cada elemento es un promedio de los isótopos de cada elemento (átomos del mismo elemento con diferente número de neutrones en el núcleo).
En el caso del sodio (Na), la masa atómica reportada es 22.98 uma.

Ilustración 1.I. Átomo. Obtenida de flickr.com (CC BY-NC-ND 2.0)
Masa molecular
La masa molecular se refiere a la masa que tiene una molécula de cierta sustancia. Se obtiene al sumar las masas atómicas de los átomos que forman a dicha molécula y, por lo tanto, se expresa en uma.
Ejemplo: si se desea conocer la masa molecular del ácido sulfúrico (H2SO4), se deberá sumar las masas atómicas de los dos átomos de hidrógeno, el único átomo de azufre y los cuatro de oxígeno que forman a la molécula, como sigue:
- Hidrógeno: (1 uma)(2) = 2 uma
- Azufre: (32 uma)(1) = 32 uma
- Oxígeno: (16 uma)(4) = 64 uma
- H2SO4: 2 uma + 32 uma + 64 uma = 98 uma
Ilustración 1.II. Molécula. Obtenida de flickr.com (CC BY-NC-ND 2.0)
Mol
Antes de definir lo que es masa molar, es importante conocer lo que es un mol. Para entenderlo, se puede decir lo siguiente:
De manera similar a una docena, una centena o un millar; es decir, para hacer referencia a una cierta cantidad de unidades: 12, 100 o 1000 unidades, respectivamente; el mol fue definido para agrupar a un número muy grande de unidades: 6 022 000 000 000 000 000 000 000 unidades (expresado como 6.022 x1023 unidades). Al contener un número tan amplio de unidades, se reserva únicamente para átomos o moléculas de las sustancias.
Para entenderlo, entonces podemos decir que:
- 1 mol de azufre, S = 6.022 x1023 átomos de azufre
- 1 mol de agua, H2O = 6.022 x1023 moléculas de agua
- 0.5 mol de calcio, Ca = (6.022 x1023)(0.5) = 3.011 x1023 átomos de calcio
- 2 mol de NaCl = (2)(6.022 x1023) = 12.044 x1023 moléculas de NaCl

Fotografía 1.I. Sales. Obtenida de flickr.com (CC BY 2.0)
Masa molar
La masa de un mol de partículas se denomina masa molar (M), pero ¿cómo se sabe cuando se ha reunido un mol de sustancia? ¿será necesario contar cada una de las 6.023 x1023 partículas? Por suerte no...
El valor numérico de la masa atómica (y también aplica para la masa molecular) coincide con la masa molar, pero esta última se expresa en gramos por cada mol de sustancia (g/mol), en lugar de uma.
Es decir, si el carbono tiene una masa atómica de 12 uma, entonces su masa molar es de 12 g/mol. Entonces, en esos 12 g, que es un mol de carbono, habrán entonces 6.022 x1023 átomos de carbono.
Explicado ahora con el agua (H2O): si la masa molecular es de 18 uma, entonces su masa molar es de 18 g/mol. Este mol tendrá, entonces, 6.022 x1023 moléculas de H2O.

Fotografía 1.II. Vaso de agua. Obtenida de flickr.com (CC BY 2.0)
Conversión mol-gramo
Existe una forma de conocer el número de mol que representa una cierta masa en gramos de sustancia, o viceversa. Para ello, se puede utilizar la fórmula:
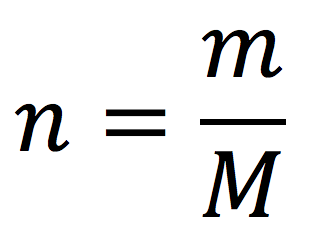
Donde:
- n: número de mol, en mol.
- m: masa de sustancia, en g.
- M: es la masa molar, en g/mol.